GxP / Regulatory-Compliance | Qualifizierung als Teil des PQS
GxP steht für die klassischen Qualitätsmanagement (QM)-Systeme in den Herstellbereichen Pharma, Medizinprodukte, Biotechnologie, u.a. sowie deren Zulieferer und Vertragspartner.
Das Pharmazeutische Qualitätssicherungssystem (PQS) bildet die Gesamtheit aller Maßnahmen, die zur Sicherstellung der erforderlichen Qualität von Arzneimitteln für den beabsichtigten Gebrauch getroffen werden. Ein effektives PQS kann deshalb keine „einmalige Bühnenaufführung“ für z.B. die Erlangung einer Herstellungserlaubnis sein, sondern muss über den gesamten Produktlebenszyklus nachgehalten und kontinuierlich verbessert werden.
Über ein effektives PQS sollen Produktrealisierung, Kontrolle und Überwachung sowie eine Kontinuierliche Verbesserung sichergestellt werden (GMP-Leitfaden Teil III, Q10 Note for Guidance on Pharmaceutical Quality System). Zur Implementierung, Aufrechterhaltung und Überwachung verfügt ein effektives PQS über folgende Elemente und Werkzeuge:
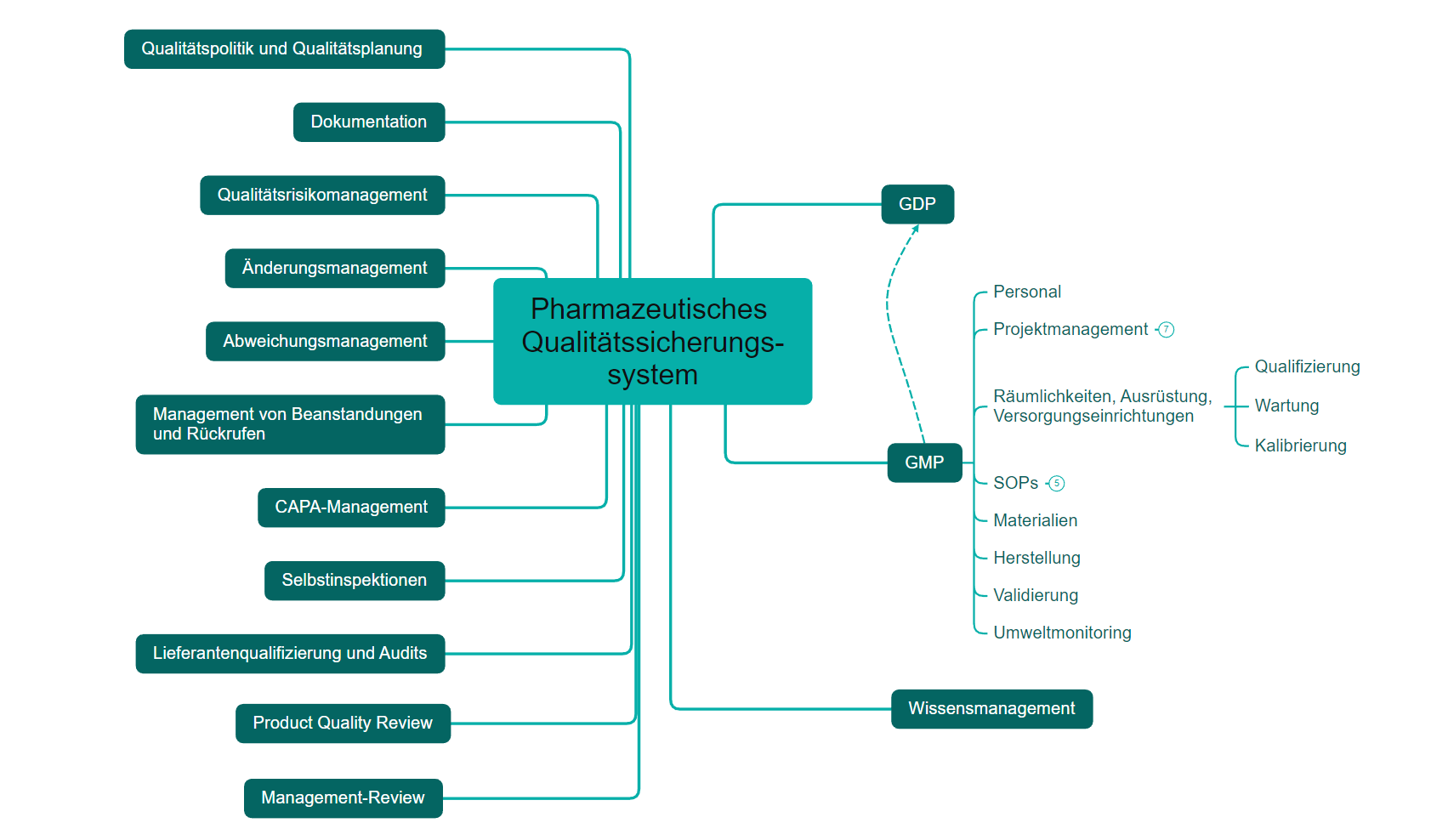
Diagramm PQS
Wir unterstützen Sie gerne bei der Entwicklung eines effektiven PQS. Dazu gehören auch eine inhaltliche Prüfung bestehender Systeme und Arbeitsanweisungen (SOPs). Wir überführen bewährte, individuelle Arbeitsabläufe in standardisierte und praxisorientierte Prozesse. Dabei ist unser Ziel, Verbesserungspotenziale aufzudecken und einen risikobasierten Ansatz durchgängig zu implementieren.
Unsere vielfältige und praktische Expertise liegt im Bereich der klassischen Pharmazie (GMP, GDP) sowie Medizinprodukte.
Bringen Sie sich in Kontakt zu P³
Sie dürfen uns ansprechen auf unsere Kompetenzen:
• Durchführung von Selbstinspektionen
• Vorbereitung, Begleitung und Nachsorge behördlicher Inspektionen
• Compliance Checks zur Prüfung von Herstellprozessen und Qualifizierungen sowie zur Aufdeckung von Verbesserungspotenzialen.
GMP-Compliance im Projekt durch intelligente Qualifizierung
Die Herstellung pharmazeutischer Produkte unterliegt höchsten Qualitätsanforderungen, insbesondere im Hinblick auf Reinheit, Sicherheit und Rückverfolgbarkeit.
Die Qualifizierung der pharmazeutischen Herstell-Systeme mit Reinräumen, Versorgungssystemen / Reinstmedien, Produktionsausrüstungen und computergestützter Systeme erfolgt besonders gemäß den Anforderungen des Annex 15 des EU-GMP-Leitfadens. Ziel ist es, den dokumentierten Nachweis zu erbringen, dass die eingesetzten Systeme geeignet sind, reproduzierbar die spezifizierten Anforderungen zu erfüllen – unter Einhaltung regulatorischer Vorgaben und im Einklang mit dem übergeordneten Qualitätssystem.
Standard ist der Integrierte C&Q-Ansatz (Integrated Commissioning & Qualification):
Um Effizienz und Compliance als Teil des Lean-Ansatz zu vereinen, erfolgt die Qualifizierung idealerweise im Rahmen eines integrierten Inbetriebnahme- und Qualifizierungskonzepts („C&Q“). Dabei werden Prüfaktivitäten aus dem technischen Inbetriebnahmeprozess (Commissioning) regulatorisch verwendet („leveraging approach“), um Wiederholungen zu vermeiden und Zeitpläne zu optimieren. Entscheidend ist es, dabei die regulatorische Nachvollziehbarkeit zu gewährleisten.
Dieses Vorgehen ist nicht nur für komplexe Projekte mit vielen Schnittstellen und hohem Automatisierungsanteil sinnvoll.
Unser Ansatz folgt einem Lean-Philosophieprinzip und fußt auf der risikobasierten Qualifizierung. Durch gezielte Risikoanalysen (z.B. als FMEA) werden kritische Qualifizierungsaktivitäten identifiziert, nicht wertschöpfende Schritte eliminiert und Prüfabläufe schlank integriert. Die klare risikobasierte Struktur der Qualifizierung deckt auf – was keine Risiko darstellt unterliegt keiner Qualifizierungsanforderung.
Ein Erfolgskriterium ist dabei ebenfalls die Akzeptanzkriterien bereits in die Risikoanalyse passend zu der Fehlerbeschreibung zu integrieren. So können die Qualifizierungspläne integrativ erstellt werden.
Anwendungsbereiche:
Facilities – z. B. Produktionsflächen als Reinräume, Lagerflächen
Utilities – z. B. HVAC-Systeme, Reinstmediensysteme (z.B. WFI, AP, Reinstdampf, Druckluft, Stickstoff, etc.
Equipment – z. B. Mischbehälter, Autoklaven, Abfüllanlagen
Computersysteme – z. B. Prozessleitsysteme, SCADA, Batch-Record-Systeme, Monitoring-Systeme (inkl. GAMP 5-konformer Validierung)
Die Dienstleistung für Ihr Projekt umfasst die vollständige Planung, Koordination und Dokumentation der Qualifizierungsphasen
– von der URS-Erstellung mit zugehöriger Risikoanalyse, Erstellung der Qualifizierungspläne für DQ, IQ, OQ, PQ über Testdurchführung bis zum finalen Abschlussbericht – unter Einhaltung geltender Normen (EU-GMP, ICH Q9/Q10, ISPE, GAMP 5).
Außerdem dürfen Sie uns ansprechen für unsere Kompetenzen zu:
• Compliance Checks zur Prüfung von Herstellprozessen und Qualifizierungen
• Aufdeckung von Verbesserungspotenzialen in Ihrem PQS oder Qualifizierungssystem
Sie benötigen eine Herstellerlaubnis?
Noch keine Herstellungserlaubnis entsprechend § 13 AMG zur Herstellung von Arzneimitteln vorhanden?
Oder steht eine Erweiterung an?
Sie erhalten kompetente Unterstützung bei der Schaffung der dafür benötigten Voraussetzungen (siehe Diagramm PQS) sowie beim Antrag auf Erteilung einer Herstellungserlaubnis.
Bringen Sie sich in Kontakt zu P³
Außerdem dürfen Sie uns ansprechen für unsere Kompetenzen:
• Durchführung von Selbstinspektionen
• Vorbereitung, Begleitung und Nachsorge behördlicher Inspektionen
